Kapsułkowanie – metoda immobilizacji materiałów bioaktywnych
- Wstęp
Kapsułkowanie jest techniką, za pomocą której jeden materiał lub mieszanina materiałów jest powlekana bądź zamykana wewnątrz innego materiału lub układu. Materiał powlekany nazywany jest aktywnym lub rdzeniem, powlekający natomiast to powłoka, nośnik, otoczka. Rozwój mikrokapsułkowanych produktów rozpoczął się w latach pięćdziesiątych ubiegłego wieku, gdy prowadzono badania w kierunku czułych na nacisk powłok do produkcji papieru do kopiowania bez kalki [1]. Obecnie technika kapsułkowania jest dobrze rozwinięta i chętnie stosowana w przemyśle farmaceutycznym, chemicznym, kosmetycznym, spożywczym oraz poligraficznym. Kapsułkowaniu poddaje się tłuszcze, oleje, związki zapachowe, oleożywice, witaminy, minerały, enzymy i barwniki [2].
Proces kapsułkowania wrażliwych związków składa się z dwóch etapów: pierwszy jest często emulsyfikacją rdzenia z gęstym roztworem materiału powłokowego, drugi etap to suszenie lub chłodzenie emulsji.
Racjonalne wykorzystanie techniki kapsułkowania wymaga fizykochemicznego zrozumienia mechanizmów, za pomocą których wybrane związki są kapsułkowane i uwalniane [3].
Opracowywane są coraz to nowsze technologie i materiały powłokowe, które w procesie mikrokapsułkowania mogą mieć bardzo szeroki zakres zastosowań. By pobudzić uwalnianie kapsułkowanego związku, wykorzystywane są chociażby takie czynniki jak: zmiana pH, oddziaływania mechaniczne, temperatura, aktywność enzymatyczna, czas, siła osmotyczna i inne [4].
Rozmiary cząsteczek klasyfikowanych jako mikrokapsułki nie mają ściśle ustalonych granic, aczkolwiek naukowcy klasyfikują kapsułki mniejsze niż 1 μm jako nanokapsułki, a większe niż 1000 μm jako mikrokapsułki. Przemysłowe mikrokapsułki maja zwykle średnicę pomiędzy 3 a 800 μm i zawierają 10-90% masowych rdzenia.
Mikrokapsułki różnią się pod względem strukturalnym, niektóre mogą mieć kształt sferyczny z ciągłym obszarem rdzenia otoczonym ciągłą powłoką, inne mogą mieć kształt nieregularny z licznymi małymi kropelkami lub cząstkami materiału rdzeniowego [5].
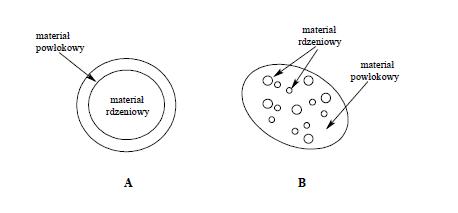
Rys. 1. Schemat ideowy dwóch typów mikrokapsułek: (A) mikrokapsułka z ciągłym rdzeniem i powłoką, (B) mikrokapsułka nieregularna wielordzeniowa [5]
- Techniki kapsułkowania
Poszukiwane i udoskonalane są coraz to nowsze techniki kapsułkowania, które skategoryzowano w dwie grupy: procesy chemiczne oraz procesy mechaniczne lub fizyczne. Nazwy te nie zawsze są adekwatne, jako że niektóre procesy klasyfikowane jako mechaniczne mogą opierać się na reakcjach chemicznych, zaś te klasyfikowane jako chemiczne mogą polegać na zjawiskach fizycznych. Poniżej scharakteryzowane zostaną procesy kapsułkowania o ważniejszym znaczeniu przemysłowym.
Procesy chemiczne
Pierwszym z procesów kapsułkowania, stosowanym do produkcji bezkalkowych papierów kopiujących, była koacerwacja. Koacerwacja jest zjawiskiem występującym w roztworach koloidalnych. Polega na oddzieleniu z roztworu koloidalnych cząstek, które aglomerują w oddzielna fazę ciekłą zwaną koacerwatem. Zwykle rdzeń w procesie koacerwacji musi być kompatybilny z polimerem – odbiorcą oraz nierozpuszczalny (lub bardzo trudno rozpuszczalny) w środowisku koacerwacji. Tolstuguzow i Rivier [6] opisali proces kapsułkowania stałych cząstek wewnątrz białka. W procesie tym cząstki w roztworze białka mieszano z polisacharydem jednocześnie utrzymując pH wyższe niż punkt izoelektryczny białka. Otrzymano w ten sposób mieszaniną dwufazową, w której cięższa z faz zawierała kapsułkowany materiał.
Koacerwacja może być prosta lub złożona. W prostej mamy do czynienia tylko z jednym rodzajem polimeru z dodatkiem silnie hydrofilowego czynnika do roztworu koloidalnego. W przypadku koacerwacji złożonej można zastosować dwa lub więcej polimerów. Koacerwacja złożona polega na zdolności wzajemnego oddziaływania w wodzie polimerów kationowych i anionowych do utworzenia ciekłej fazy bogatej w polimery, zwanej koacerwatem złożonym. Najczęściej stosowanym w tym przypadku kationowym polimerem jest żelatyna. Różnorodne, naturalne i syntetyczne, rozpuszczalne w wodzie polimery reagują z żelatyną tworząc złożone koacerwaty odpowiednie do kapsułkowania, które występują w równowadze z klarowna cieczą na powierzchni [3,5].
Niekompatybilność polimer-polimer jest również często stosowaną w przemyśle techniką kapsułkowania. Technika ta wykorzystuje fenomen polimerowego rozdziału faz, różniącego się nieco od złożonej koacerwacji. W tym drugim przypadku dwa różnie naładowane polimery łączą się razem, tworząc złożony koacerwat i obydwa są częścią końcowej powłoki kapsułki. W niekompatybilności polimer-polimer dwa chemicznie różne polimery rozpuszczone są we wspólnym rozpuszczalniku, są niekompatybilne i nie mieszają się w roztworze. Zasadniczo polimery te odpychają się wzajemnie tworząc dwie oddzielne fazy ciekłe. Jedna z faz jest bogata w polimer przeznaczony do formowania powłoki kapsułkowej, druga zawiera niekompatybilny polimer, obecny w układzie tylko po to by utworzyć oddzielną fazę. Nie przewiduje się jego obecności w końcowym składzie powłoki, jednak może się w niej pojawić w postaci zanieczyszczeń [5].
Polimeryzacja międzyfazowa jest kolejną technika kapsułkowania zaliczaną do procesów chemicznych. W polimeryzacji międzyfazowej dwa reaktanty spotykają się na powierzchni międzyfazowej reagując ze sobą błyskawicznie. Podstawą tej metody jest klasyczna reakcja Schotten – Baumanna pomiędzy chlorkiem kwasowym (lub innym rozpuszczalnym w rozpuszczalniku reaktantem, jak np. izocyjanian), a związkami zawierającymi aktywny wodór, jak aminy, alkohole, poliestry, polimoczniki, poliuretany. W określonych warunkach na powierzchni międzyfazowej zachodzi natychmiastowa polimeryzacja i tworzy się cienka elastyczna powłoka polimeru, tworząca kapsułkę. Tym sposobem immobilizuje się często materiały biologiczne, m. in. aktywne enzymy [5, 7].
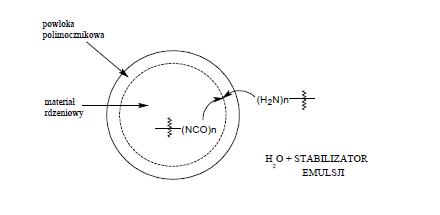
Rys. 2. Schemat międzyfazowej reakcji często stosowanej do produkcji kapsułek w wyniku polimeryzacji międzyfazowej [5]
Polimeryzacja in situ jest techniką dość zbliżoną do polimeryzacji międzyfazowej i podobnie jak w tamtym przypadku, tworzenie powłok kapsułkowych następuje w wyniku polimeryzacji monomeru dodawanego do reaktora kapsułkowania. W procesie tym do materiału rdzeniowego nie dodawane są żadne środki aktywujące, a polimeryzacja zachodzi wyłącznie w fazie ciągłej. Początkowo tworzy się prepolimer o niewielkiej masie molowej, w miarę upływu czasu zwiększa swe rozmiary odkładając się na powierzchni rozproszonego materiału rdzeniowego tworząc stałą powłokę kapsułki. Technikę tą można zastosować do kapsułkowania różnych nie mieszających się z wodą cieczy w powłokach utworzonych w wyniku reakcji mocznika (pH kwaśne) z formaldehydem w środowisku wodnym [5,8].
Procesy fizyczne lub mechaniczne
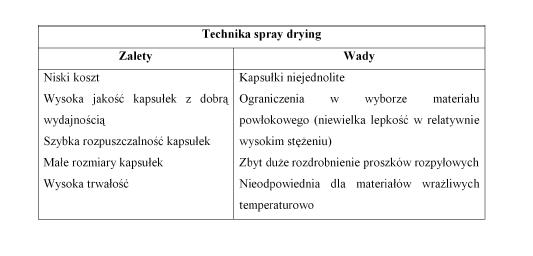
Suszenie rozpyłowe (spray drying) jest niezbyt kosztowną techniką przemysłową, przede wszystkim stosowaną do kapsułkowania aromatów, olejków, substancji smakowych. Emulsja jest sporządzana w wyniku dyspersji materiału rdzeniowego nie mieszającego się z wodą w stężonym roztworze materiału powłokowego, do momentu otrzymania kropel o pożądanych rozmiarach. Otrzymana emulsja jest rozpylana w postaci kropel za pomocą pompy zawiesinowej, przez obrotową tarczę, do gorącej komory suszarki rozpyłowej. Tam woda z emulsji zostaje odparowana i otrzymujemy wysuszone kapsułki o różnych kształtach, które zawierają rozproszone krople materiału rdzeniowego. Technika spray drying choć bardzo popularna (znana od 1930r.) i często stosowana, obok swoich zalet posiada również szereg wad (tab. 1) [3,8].
Tabela 1. Wady i zalety kapsułkowania techniką spray drying [3]
By uniknąć problemów związanych ze zbyt dużym rozdrobnieniem proszków otrzymywanych w technice spray drying, poddaje się je procesowi aglomeracji. Proces ten jest charakterystyczny dla kolejnej techniki jaką jest powlekanie złożem fluidalnym (fluid bed coating). Technika ta ogranicza się do kapsułkowania stałych cząstek, lub materiałów porowatych, na których zaadsorbowana jest ciecz. Bardzo dużą zaletą tej techniki jest możliwość zastosowania różnorodnych preparatów do powlekania, jak lateksowe dyspersje wodne, roztwory materiałów powłokowych w rozpuszczalnikach organicznych lub wodne roztwory materiałów powłokowych. Proces powlekania złożem fluidalnym jest obecnie głównie stosowany w przemyśle farmaceutycznym i kosmetycznym, przede wszystkim z powodu ich większych możliwości budżetowych, jednak podejmowano tez próby wykorzystywania go w przemyśle spożywczym [9]. Wyróżnia się trzy typy powlekania złożem fluidalnym: rozpylanie z góry, z dołu i styczne.
W układzie z górnym rozpylaniem, materiał powłokowy jest rozpylany w dół na złoże fluidalne aż cząsteczki stałe bądź porowate przesuną się do obszaru powlekania, gdzie będą kapsułkowane. Wysoka wydajność kapsułkowania i ochrona przed tworzeniem się skupisk jest możliwa dzięki odwrotnemu przepływowi materiału powłokowego i stałych cząstek. W metodzie z górnym rozpylaniem otrzymuje się wyższą wydajność kapsułkowania niż w dwóch pozostałych [5,8].
Technika z rozpylaniem z dołu znana także jako „powlekanie Wurstera”, stosuje komorę powlekającą zaopatrzoną w cylindryczną dyszę i perforowana formę podstawy. Cylindryczna dysza rozpyla materiał powłokowy, a cząstki przesuwają się w górę przez perforowaną podstawę i mijając obszar dyszy są kapsułkowane w materiale powłokowym. Materiał powłokowy przylega do powierzchni cząsteczek przez odparowanie rozpuszczalnika lub schłodzenie kapsułkowanej cząsteczki. Proces ten jest kontynuowany do momentu osiągnięcia pożądanego rozmiaru i wagi [8].
W trzecim typie powlekania z rozpylaniem stycznym, komora powlekająca posiada na dnie obrotową płytę, o takiej samej średnicy jak podstawa samej komory. W trakcie procesu płyta unosi się, tworząc przestrzeń pomiędzy ściankami komory a brzegiem płyty. Styczna dysza umiejscowiona powyżej obrotowej płyty uwalnia materiał powłokowy, a cząstki przemieszczające się utworzoną przestrzenią są wówczas kapsułkowane [8].
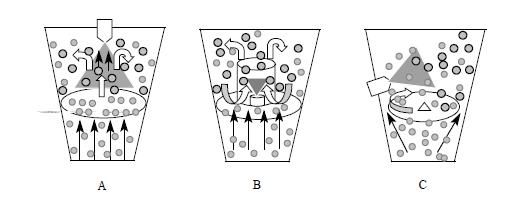
Rys. 3. Schemat powlekania złożem fluidalnym: (A) z rozpylaniem górnym, (B) z rozpylaniem dolnym, (C) z rozpylaniem stycznym [8]
W kolejnej metodzie zwanej wytłaczaniem wirowym (centrifugal extrusion), materiał rdzeniowy i powłokowy, jako dwie nie mieszające się ciecze, pompowane są przez wirującą dwu-strumieniową dyszę. Powoduje to utworzenie ciągłego słupa dwóch cieczy, który natychmiast po tym jak wyłoni się z dyszy, spontanicznie rozpada się na swobodnie płynące sferyczne krople. Każda kropla zawiera ciągły obszar rdzenia otoczony ciągłą powłoką. Sposób w jaki te krople są przekształcane na kapsułki jest determinowany przez naturę materiału powłokowego. Jeżeli materiał powłokowy jest gorącym wytopem o relatywnie niskiej lepkości, który krystalizuje natychmiast po schłodzeniu (np. wosk, wosk utwardzany w polimerze), krople są przekształcane w stałe cząstki zaraz po tym jak opuszczą dyszę. Odpowiednimi rdzeniami są wówczas typowe polarne ciecze, jak roztwory wodne. Alternatywnie, krople opuszczające dyszę mogą mieć powłokę, będącą wodnym roztworem polimeru, zdolnym do natychmiastowego żelowania. W tym przypadku krople kierowane są do kąpieli żelującej, gdzie są przekształcane w żelowe podłoża. Specyficznym przykładem takiego materiału powłokowego jest wodny roztwór alginianu sodu umieszczony w żelującej kąpieli wodnego CaCl2. Utworzone w ten sposób podłoża suszy się by utworzyć kapsułki ze stałymi powłokami. Odpowiednie do tego rodzaju powłok kapsułkowych są materiały rdzeniowe nie mieszające się z wodą tj. oleje [5].
Jeszcze innym przykładem mechanicznego procesu kapsułkowania jest rotacyjny rozdział suspensyjny (rotational suspension separation), w którym wewnętrzna faza jest rozproszona w ciekłym materiale powłokowym, a cała mieszanina jest przekazywana na obrotowy dysk. Krople czystego materiału powłokowego są wyrzucane na obrzeże dysku razem z nieciągłymi cząsteczkami materiału rdzeniowego zamkniętymi w podłożu. Po zestaleniu się przez schłodzenie, mikrokapsułki zbierane są oddzielnie niż cząstki materiału powłokowego [5].
- Kapsułkowanie związków smakowych i zapachowych
Olbrzymimi możliwościami związanymi z techniką mikokapsułkowania w coraz większym stopniu zainteresowani są technolodzy żywności. Jednakże koszty tego procesu dla przemysłu spożywczego są dużo wyższe niż np. dla przemysłu farmaceutycznego czy kosmetycznego. Dlatego też koszt zastosowania kapsułkowanego produktu musi być dopuszczalny dla końcowego artykułu spożywczego [4].
Kapsułkowanie okazało się dobrą metodą by zatrzymać aromat w produktach spożywczych podczas przechowywania, minimalizując niepożądane interakcje pomiędzy zapachami z pożywienia, dodatkowo chroni przed reakcjami utleniania, zwiększa trwałość aromatu oraz pozwala na kontrolowane uwalnianie. Zatrzymanie zapachu jest regulowane przez czynniki powiązane z chemiczną naturą rdzenia, łącznie z jego masą cząsteczkową, chemiczną funkcyjnością, polarnością i względną lotnością, jest również związane z właściwościami materiału powłokowego oraz samego procesu kapsułkowania.
Rozmiar kapsułek z aromatem jest zróżnicowany i może osiągać od kilku milimetrów do mniej niż jednego mikrometra. Najprostsze z mikrokapsułek mogą składać się z rdzenia otoczonego przez powłokę o równomiernej lub nierównomiernej grubości. Materiał rdzeniowy może być jednoskładnikowy lub złożony z kilku różnych składników, podobnie jak nośnik, który występuje w postaci jedno- lub wielowarstwowej. Mikrokapsułki są zwykle dodatkiem do większego układu i powinny się do niego dostosować, dlatego też muszą spełniać szereg wymagań eksploatacyjnych. O ile liczba metod kapsułkowania środków spożywczych jest ograniczona, o tyle istnieje olbrzymi zakres różnych materiałów, które można do tych metod wykorzystywać. Obejmują one białka, węglowodany, tłuszcze, żywice (gumy) i celulozę. Każda grupa materiałów posiada pewne wady i zalety, dlatego wiele powłok to złożone preparaty któregokolwiek lub wszystkich z wymienionych materiałów. Wybór materiału powłokowego zależy od wielu czynników: przeznaczenia końcowego produktu, natury rdzenia, procesu kapsułkowania, kosztów oraz aprobaty Europejskiego Urzędu ds. Bezpieczeństwa Żywności.
Nośniki do kapsułkowania związków odpowiedzialnych za wrażenia smakowe i zapachowe nie mogą reagować z materiałem rdzeniowym, powinny pozwalać na całkowite wyeliminowanie rozpuszczalnika w procesach wymagających desolwatacji, chronić w maksymalnym stopniu składniki aktywne przed czynnikami zewnętrznymi, zapewnić dobre właściwości stabilizujące emulsję oraz odpowiednie zachowanie redyspersyjne, po to, by w odpowiednim czasie i miejscu uwolnić aromat [3].
- Kapsułkowanie leków
Mikrokapsułkowanie jest jedną z podstawowych metod powlekania aktywnych substancji leczniczych. Wiele technik kapsułkowania, obejmujących m. in. wodny rozdział faz (koacerwację), trójfazową dyspersję czy polimeryzację międzyfazową, jest stosowanych do powlekania farmaceutyków oraz ich powolnego uwalniania z mikrokapsułki [10].
Bardzo duże znaczenie ma dla przemysłu farmaceutycznego właśnie technika koacerwacji. Mikrokapsułki otrzymywane ta metodą odznaczają się skutecznym utrzymywaniem i kontrolowanym uwalnianiem leku, redukują parowanie olejków lotnych, chronią leki wrażliwe na wilgoć, światło i utlenianie, a także maskują nieprzyjemny smak i zapach. Metodą tą kapsułkowanych jest wiele leków należących do różnych grup farmaceutycznych jak antybiotyki [11], środki przeciwzapalne [12], leki rozszerzające oskrzela, sulfonamidy, diuretyki, preparaty przeciwbakteryjne, przeciwbólowe, antyepileptyczne, sole metali, witaminy i inne [13].
Kapsułkowanie liposomowe jest techniką głównie wykorzystywaną w przemyśle farmaceutycznym, gdyż liposomy (szczególnie modyfikowane) mogą służyć do projektowania leków działających wybiórczo. Technika ta jest również często stosowana w kosmetykach, np. do stabilizacji odżywczych składników w kremach [4]. W ostatnich latach podjęto też próby kapsułkowania liposomowego w przemyśle spożywczym [14].
Tak częste stosowanie tej techniki wynika z niskiej toksyczności i/lub udoskonalonej skuteczności leku kapsułkowanego w układach liposomowych. Powód, dla którego liposomy osłabiają toksyczność leku nie jest do końca znany, ale jest to przypuszczalnie związane ze zmianami farmakokinetycznymi leku. Bardzo obiecujące działania terapeutyczne ma zastosowanie liposomów jako powłok na leki antyrakowe [15], przeciwgrzybiczne [16], przeciwbakteryjne, antywirusowe[17] i przeciwpasożytnicze.
Zagadnienia związane z rodzajem liposomów stosowanych jako materiały powłokowe i procedurą kapsułkowania dotyczą różnorodnych technik stosowanych do przygotowania liposomów, przykładowych wymagań wynikających z rodzaju kapsułkowanego leku i pożądanych efektów biologicznych gotowego preparatu. Technika kapsułkowania musi spełniać takie wymagania jak wysoka skuteczność powlekania i sensownie długi czas retencji. W dodatku, niektóre ważne leki posiadają charakter lipofilowy, co może skutkować szybkim uwalnianiem się leku z powłoki liposomowej. Innym bardzo ważnym aspektem jest zachowanie się liposomów wewnątrz żywego ustroju, który jest bardzo wrażliwy na rozmiar i skład pęcherzyków. Wszystkie te problemy są rozważane zanim zostanie podjęta decyzja o najodpowiedniejszym dla konkretnego leku rodzaju liposomu oraz właściwej technice kapsułkowania [18].
Jeżeli chodzi o syntetyczne powłoki polimerowe do kapsułkowania leków, najczęściej wykorzystuje się alifatyczne poliestry oparte na kwasie mlekowym i kwasie glikolowym (PLGA). Opracowano wiele metod do kapsułkowania różnego rodzaju leków z zastosowaniem PLGA [19,20]. Najodpowiedniejszą do tych celów wydaje się być jednak metoda podwójnej emulsji typu woda/olej/woda (w/o/w). Mikrokapsułki powstałe tą metodą są na ogół gładkie, sferyczne i pozwalają na długotrwałe uwalnianie leku. Jakkolwiek, na tempo uwalniania znacząco wpływają też właściwości fizykochemiczne leku, polimer, stosowany rozpuszczalnik organiczny i proces emulsyfikacji. Co więcej wydajność kapsułkowania leków rozpuszczalnych w wodzie wewnątrz PLGA jest często niższa, dlatego też wciąż podejmowane są próby zwiększenia wydajności kapsułkowania przez zmianę parametrów procesu [21].
- Mikrokapsułkowanie enzymów
Najlepszym sposobem do immobilizowania enzymu, by w jak najmniejszym stopniu naruszyć jego strukturę, jest właśnie kapsułkowanie. Kapsułkowanie enzymu jest jego fizycznym „zamknięciem” wewnątrz polimerowej powłoki (sztucznej bądź naturalnej) przez przemianę fazową roztworu polimeru zawierającego enzym. Kapsułkowanie enzymów można przeprowadzać m. in. w wyniku takich procesów jak koacerwacja, polimeryzacja międzyfazowa, odparowanie rozpuszczalnika czy powlekanie rozpyłowe [22]. Spośród tak wielu różnych metod kapsułkowania enzymów najbardziej obiecującym i coraz częściej stosowanym jest technika zol – żel. Zol-żele są wysoce porowatymi materiałami krzemionkowymi, które są z łatwością preparowane i modyfikowane (rys. 4). Otrzymany zol -żel jest chemicznie obojętnym szkłem, które może być formowane w pożądane kształty i zaprojektowane tak by wykazywać odporność termiczną i mechaniczną. W pierwszym etapie tetra-alkoksysilan, jak np. tetrametoksysilan (TMOS) jest hydrolizowanyw obecności kwaśnego katalizatora. W wyniku hydrolizy i kondensacji tworzy się zol, który jest mieszaniną częściowo zhydrolizowanych i częściowo skondensowanych monomerów. Dalsza kondensacja prowadzi do utworzenia żelu, którego wszystkie pory są wypełnione wodą, dlatego nazywany jest aqua żelem. Aqua żel można osuszyć przez odparowanie wody i alkoholu, w tych warunkach siły kapilarne spowodują znaczne skurczenie zol-żelu, tracąc na strukturze. Otrzymany w ten sposób suchy żel nazywany jest również xero żelem. Jeżeli woda i alkohol są wymieniane na aceton, a następnie na ditlenek węgla w stanie nadkrytycznym , aqua żel może być wysuszony z pominięciem sił kapilarnych, a w związku z tym można uniknąć kurczenia się żelu. Aero żel otrzymany w ten sposób posiada olbrzymie objętości porów, ale jest raczej kruchy. Różne zol-żele otrzymywane według powyższego schematu są hydrofilowe. Gdy do mieszaniny syntezowej dodamy alkilotrialkoksysilan, jak np. metylotrimetoksysilan (MTMS), powstały zol-żel będzie miał powierzchnię hydrofobową. Zatem bezpośrednie zmiany w syntezie pozwalają na modyfikacje żelu, zapewniając tym samym możliwość zastosowania zol-żelu jako nośnika hydrofilowego, który tworzy wiązania wodorowe z enzymem, lub hydrofobowego [23].
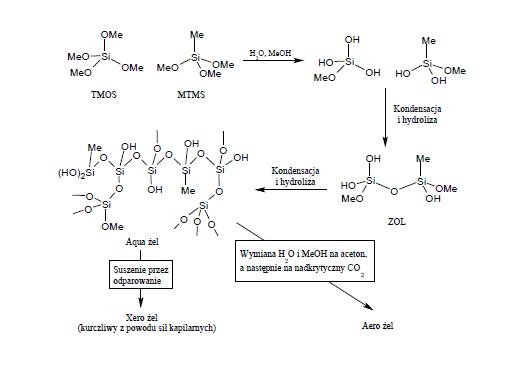
Rys. 4. Synteza zol-żelu [23].
Do niedawna enzymy były niedoceniane jako katalizatory w syntezach organicznych głównie z powodu ich wysokiej ceny, zanieczyszczenia produktów przez szczątkowe białka oraz niską stabilność. Jednak kapsułkowanie białek w mezoporowatych krzemionkach spowodowało wzrost ich odporności na rozpuszczalniki organiczne bądź otoczenie. Enzymy, szczególnie te znane jako proteiny membranowe występujące w błonach komórkowych, kierują ważnymi i skomplikowanymi reakcjami w organizmach żywych. Itoh i wsp. [24] podjęli próby wyekstrahowania i kapsułkowania takiego enzymu, by efektywnie wykorzystać jego funkcje w katalizie. Otrzymali oni regularne układy katalazy kapsułkowanej w mezoporowatej krzemionce, która odznaczała się aktywnością zbliżona do naturalnego enzymu, a także większa stabilnością i odpornością.
Zhang i wsp. [25] kapsułkowali z kolei β-glukuronidazę w biomimetycznej masie alginianowo – protaminowo – krzemionkowej. Wyniki ich eksperymentu dowiodły, że tolerancja temperaturowa i pH, jak również stabilność podczas przechowywania i wielokrotnego użycia, była znacznie lepsza dla kapsułkowanego enzymu.
Aranaz i wsp. [26] jako pierwsi zastosowali złożony polielektrolit alginianowo – chitozanowy do ko-immobilizacji enzymów katalizujących wielostopniowy proces produkcji D-aminokwasów. Kapsułkowano w tym celu surowy ekstrakt komórek Agrobacterium radiobacter zawierający D-hydantoinazę i D-karbamylazę.
Enzymy kapsułkowano też w naturalnie występującym polisacharydzie, κ-karageninie, który jest nietoksycznym, powszechnie dostępnym polimerem o bardzo dużych masach cząsteczkowych. Jagannathan i wsp. [22] stosując technikę ko-ekstruzji, należącą do procesów mechanicznych, kapsułkowali w karageninie lipazę. W procesie tym dwa ciekłe strumienie wypływają przez współśrodkowe dysze pod działaniem siły, w jednej znajduje się ciekły roztwór materiału rdzeniowego do kapsułkowania, w drugiej polimer.
- Podsumowanie
Na dzień dzisiejszy zastosowanie metody kapsułkowania w różnych gałęziach przemysłu, jak też wszelkich biologicznych dziedzinach nauki zdaje się być nieograniczone. Skuteczność kapsułkowania nie polega jedynie na udoskonalaniu lub wyborze właściwej techniki, ale wymaga też biegłości w rozwoju procesów technologicznych. Postęp immobilizowania związków smakowych i zapachowych, leków, czy też enzymów z użyciem technik kapsułkowania jest ogromny. Rozwinęły się one od prostej immobilizacji czy pułapkowania materiału rdzeniowego, do tworzenia wyszukanych i precyzyjnych mikrokapsułek.
Literatura
1. Green B.K., Pressure sensitive record material, US Patent Office, Nr 2,712,507, (1995)
2. Gibbs B.F., et al., International Journal of Food Science and Technology, 1999, 50, 213-224
3. Madene A., et al., International Journal of Food Science and Technology, 2006, 41, 1-21
4. Gouin S., Trends in Food Science and Technology, 2004, 15, 330-347
5. Benita S., Microencapsulation – Methods and Industrial Aplications, Marcel Dekker, Inc., New York, 1996
6. Tolstuguzov V.B., Rivier V., Encapsulated Particles in Protein from a Polisaccharide-Conteining Dispersion. European Patent Application, EP 0797925, Nestle SA
7. Vidhyalakshmi R., et al., Advances in Biological Research, 2009, 3 (3-4), 96-103
8. Jyothi N. V., et al., : Microencapsulation Techniques, Factors Influencing Encapsulation Efficiency: A Review. The Internet Journal of Nanotechnology, 2009, 3, nr 1 [dostęp online: http://www.ispub.com/journal/the_internet_journal_of_nanotechnology/volu…
9. Lee S.Y., Krochta J.M., Journal of Agricultural and Food Chemistry, 2002, 50, 2022-2028
10. Lieberman H.A., Lachman L., Schwartz J.B., Pharmaceutical Dosage Forms: Tablets Vol. 3, Marcel Dekker, Inc., New York, 1990
11. Goto S., et al., Journal of Microencapsulation, 1984, 1, 137-155
12. Bhatnagar S., Nakhare S., Vyas S.P., Journal of Microencapsulation, 1995, 12, 13-22
13. Wise D.L., Handbook of Pharmaceutical Controlled Release Technology, Marcel Dekker, Inc., New York, 2000
14. Kim H.H.Y., Baianu I.C., Trends Food Science and Technology, 1991, 2, 55-61
15. Poznansky M.J., Juliano R.L., Pharmacological Review, 1984, 36, 277-336
16. Mehta R.T., et al., Antymicrobial Agents and Chemotherapy, 1987, 31, 1897-1900
17. Vasudevachari M.B., Antony A., Indian Journal of Experimental Biology, 1985, 23, 393-396
18. Mayer L.D., Chemistry and Physics of Lipids, 1986, 40, 333-345
19. Jain R.A., Biomaterials, 2000, 21, 2475-2490
20. Redhead H.M., et al., Journal of Controlled Release, 2001, 70, 353-363
21. Mandal T.K., Pharmaceutical Research, 2002, 19, 1713-1719
22. Jegannathen K.R., et al., Journal of Molecular Catalysis B: Enzymatic, 2009, 58, 78-83
23. Fessner W.-D., Anthonsen T., Modern Biocatalysis, WILEY-VCH Verlag GmbH & Co. KGaA, 2009
24. Itoh T., et al., Journal of Molecular Catalysis B: Enzymatic, 2009, 57, 183-187
25. Zhang Y., et al., Journal of Molecular Catalysis B: Enzymatic, 2009, 57, 130-135
26. Aranz I., Acosta N., Heras A., Journal of Molecular Catalysis B: Enzymatic, 2009, 58, 54-64
*Prof. dr hab. inż. Jan Ogonowski – kierownik Katedry Technologii Organicznej i Procesów Rafineryjnych na Wydziale Inżynierii i Technologii Chemicznej Politechniki Krakowskiej.
Mgr inż. Elwira Lasoń ukończyła Wydział Inż. i Techn. Chemicznej Politechniki Krakowskiej, specjalność „Lekka technologia organiczna“ w 2008. Obecnie pracuje w Instytucie Chemii i Technologii Organicznej PK. Specjalność: technologia organiczna, biotechnologia, procesy katalityczne.

